
Introducción del producto
| Piridina Información básica |
| Estructura Química Propiedades químicas Producciones Usos Información de toxicidad Peligros Referencias |
| Nombre del producto: | piridina |
| Sinónimos: | ácido piridinacarboxílico,2-(4,5-dihidro-4-metil-4-(1-metiletil)-5-oxo-1h-imidazol{ {9}}il)-5-metilo;ácido piridinacarboxílico,2-(4,5-dihidro-4-metil-4-(1-metiletilo){{ 17}}oxo-1h-imidazol-2-il)-5-metilo, sal monoamónica; número de residuos Rcra U196; número de residuos cra u196; FEMA 2932; FEMA 2966; NÚMERO FEMA 2966; azabenceno |
| TAS: | 110-86-1 |
| MF: | C5H5N |
| MM: | 79.1 |
| EINECS: | 203-809-9 |
| Categorías de Producto: | Botellas de vidrio ámbar; RMN; Frascos de solvente; Solvente por aplicación; Solvente por tipo; Opciones de empaque de solvente; Solventes biotecnológicos Solventes; Frascos de solvente; Solventes; ¿Seguro/Sello? Frascos; Grado espectrofotométrico; Solventes espectrofotométricos; Solventes para espectroscopia (IR; UV/Vis); Organostanos; Tributilstanny; Química; PS; Clasificación alfa; Volátiles/ Semivolátiles; Botellas de vidrio ámbar; Productos de grado solvente ReagentPlus(R); Solventes ReagentPlus(R) ;Solventes de grado ACS;Solventes CHROMASOLV PlusCHROMASOLV (HPLC, LC-MS);CHROMASOLV(R) Plus;LC-MS Plus y gradiente;Alfabético;P;PU - PZ;Piridina;Organohaluros;Éster borónico;Organoboros;Organosilano;ACS GradeSemi - Solventes a granel; Solventes de grado ACS; Latas de acero al carbono con roscas NPT; Solventes para contenedores retornables; Solventes de grado ACS y reactivo; ReagentPlus; Productos de grado solvente ReagentPlus; Solventes biotecnológicos; Frascos seguros/sellados; Grado ACS; Reactivos analíticos; Reactivos analíticos para uso general ;Analítico/Cromatografía;Multi-Compendial;Puriss pa;Puriss pa ACS;Botellas recubiertas de PVC;Botellas de aluminio;CHROMASOLV Plus;Reactivos de cromatografía y disolventes de grado HPLC y HPLC Plus (CHROMASOLV);solventes de HPLC/UHPLC (CHROMASOLV);UHPLC Solventes (CHROMASOLV); Solventes de grado ACS; Latas de acero al carbono con roscas NPT; Solventes semi-a granel; Halogenados; Fluorados; Bloques de construcción; Ácido borónico; Carboxi; Alcoxi; Reactivos analíticos para uso general; OP, Puriss pa;Puriss pa;OP , Puriss pa ACS;Puriss pa ACS;Botellas de aluminio;Listados alfabéticos;Sabores y fragancias;OP;Solventes de grado espectrofotométrico;Solventes de grado espectrofotométrico;Botellas recubiertas de PVC;Productos de grado solvente ReagentPlus(R)Solventes;Solventes de grado anhidroSolventes;Solventes anhidros;{{10} };bc0001 |
| Archivo Mol: | 110-86-1.mol |
 |
|
| Propiedades químicas de la piridina |
| Punto de fusion | -42 grado (lit.) |
| Punto de ebullición | 115 grados (iluminado) |
| densidad | 0.978 g/mL a 25 grados (lit.) |
| densidad del vapor | 2,72 (frente al aire) |
| presión de vapor | 23,8 mm Hg (25 grados) |
| índice de refracción | n20/D 1.509(iluminado) |
| FEMA | 2966|PIRIDINA |
| fp | 68 grados F |
| temperatura de almacenamiento. | Almacenar entre +5 grados y +30 grados. |
| solubilidad | H2O: de acuerdo |
| PKA | 5,25 (a 25 grados) |
| forma | Líquido |
| Color | incoloro |
| Olor | Olor nauseabundo detectable entre 0.23 y 1,9 ppm (media=0.66 ppm) |
| polaridad relativa | 0.302 |
| PH | 8,81 (H2O, 20 grados) |
| límite explosivo | 12.4% |
| Umbral de olor | 0.063 ppm |
| Tipo de olor | sospechoso |
| Solubilidad del agua | Miscible |
| Punto de congelación | -42 grado |
| λmáx | λ: 305 nm Amáx: 1.00 λ: 315 nm Amáx: 0.15 λ: 335 nm Amáx: 0.02 λ: {{0}} nm Amax: 0,01 |
| merck | 14,7970 |
| BRN | 103233 |
| Constante de la ley de Henry | 18,4 a 30 grados (espacio de cabeza-GC, Chaintreau et al., 1995) |
| Limites de exposición | TLV-TWA 5 ppm (-15 mg/m3) (ACGIH, MSHA y OSHA); STEL 10 ppm (ACGIH), IDLH 3600 ppm (NIOSH). |
| Constante dieléctrica | 12,5 (20 grados) |
| Estabilidad: | Estable. Inflamable. Incompatible con agentes oxidantes fuertes, ácidos fuertes. |
| InChiKey | JUJWROOIHBZHMG-UHFFFAOYSA-N |
| Iniciar sesión | 0.64 a 20 grados |
| Referencia de la base de datos CAS | 110-86-1(Referencia de la base de datos CAS) |
| Referencia de química del NIST | Piridina(110-86-1) |
| IARC | 2B (Vol.77, 119) 2019 |
| Sistema de registro de sustancias de la EPA | Piridina (110-86-1) |
| Información de seguridad |
| Códigos de peligro | T,N,F,Xn |
| Declaraciones de riesgo | 11-20/21/22-39/23/24/25-23/24/25-52-36/38 |
| Declaraciones de seguridad | 36/37/39-38-45-61-28A-26-28-24/25-22-36/37-16-7 |
| OEB | A |
| OEL | TWA: 5 ppm (15 mg/m3) |
| RIDADR | ONU 1282 3/PÁG. 2 |
| WGK Alemania | 2 |
| RTECS | UR8400000 |
| F | 3-10 |
| Temperatura de autoignición | 482 grados |
| Nota de peligro | Altamente inflamable/nocivo |
| TSCA | Sí |
| Código hs | 2933 31 00 |
| Nivel de riesgo | 3 |
| Grupo de embalaje | II |
| Datos de sustancias peligrosas | 110-86-1(Datos de sustancias peligrosas) |
| Toxicidad | LD50 por vía oral en ratas: 1,58 g/kg (Smyth) |
| IDLA | 1,000 ppm |
| Información MSDS |
| Proveedor | Idioma |
|---|---|
| SigmaAldrich | Inglés |
| acros | Inglés |
| ESPARTO | Inglés |
| Uso y síntesis de piridina |
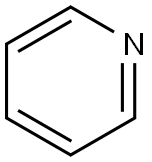
| Estructura química | La piridina es un compuesto orgánico heterocíclico básico con la fórmula química C5H5N. Está estructuralmente relacionado con el benceno, con un grupo metino (=CH-) reemplazado por un átomo de nitrógeno. El anillo de piridina se encuentra en muchos compuestos importantes, incluidas las azinas y las vitaminas niacina y piridoxina.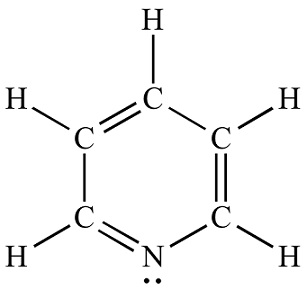 Estructura de piridina Lewis |
| Propiedades químicas | La piridina es un líquido inflamable incoloro con un fuerte y desagradable olor a pescado. piridina |
| Producciones | 2.1 Separación del alquitrán Las bases de piridina son constituyentes de los alquitranes. Fueron aislados del alquitrán de hulla o del gas de hulla antes de que se establecieran los procesos de fabricación sintéticos. Las cantidades contenidas en el alquitrán de hulla y el gas de hulla son pequeñas y las bases de piridina aisladas de ellos son una mezcla de muchos componentes. Por tanto, con algunas excepciones, el aislamiento de bases de piridina puras fue costoso. Hoy en día, casi todas las bases de piridina se producen por síntesis.2.2 Síntesis de chichibabina 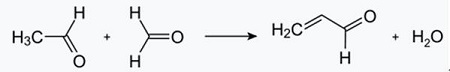 Figura 2-1Formación de acroleína a partir de acetaldehído y formaldehído. 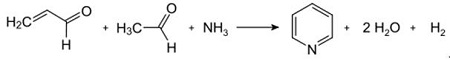 Figura 2-2Condensación de piridina a partir de acroleína y acetaldehído. La síntesis de piridina Chichibabin se informó en 1924 y todavía se utiliza en la industria. El acetaldehído y el formaldehído reaccionan con el amoníaco para dar principalmente piridina. En primer lugar, la acroleína se forma en una condensación de Knoevenagel a partir de acetaldehído y formaldehído. Luego se condensa con acetaldehído y amoníaco para obtener dihidropiridina y luego se oxida con un catalizador de estado sólido para obtener piridina. La reacción suele llevarse a cabo a 350-550°C y una velocidad espacial de 500-1000 h-1en presencia de un catalizador ácido sólido (por ejemplo, sílice-alúmina). El producto consta de una mezcla de piridina, piridinas simples metiladas (picolina) y lutidina. La piridina recuperada se separa de los subproductos en un proceso de varias etapas. 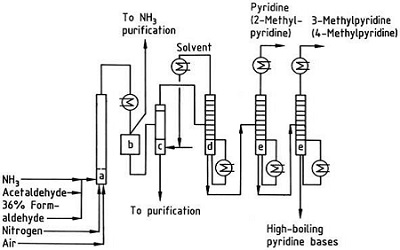 Figura 2-3Diagrama de flujo de producción de piridina y metilpiridina a partir de acetaldehído y formaldehído con amoniaco. A) Reactor; b) Coleccionista; c) Extracción; d) Destilación de solventes; e) Destilación 2.3 Desalquilación de alquilpiridinas La piridina se puede preparar mediante desalquilación de piridinas alquiladas, que se obtienen como subproductos en la síntesis de otras piridinas. La desalquilación oxidativa se lleva a cabo utilizando aire sobre un catalizador de óxido de vanadio (V), mediante desalquilación con vapor sobre un catalizador a base de níquel o por hidrodesalquilación con un catalizador a base de plata o platino. Se pueden lograr rendimientos de piridina de hasta el 93% con el catalizador a base de níquel. 2.4 Síntesis de nitrilos y acetileno La reacción en fase líquida de nitrilos con acetileno se lleva a cabo a 120-180 ?C y 0.8-2.5 MPa en presencia de un catalizador de organocobalto y da 2-piridinas sustituidas : 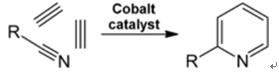 Figura 2-4Síntesis de 2-metilpiridina a partir de nitrilos y acetileno La trimerización de una parte de una molécula de nitrilo y dos partes de acetileno en piridina se llama ciclación de Bönnemann. Cuando se utiliza acetonitrilo como nitrilo, se obtiene 2-metilpiridina, que puede desalquilarse a piridina. 2.5 Síntesis de acrilonitrilo y cetonas 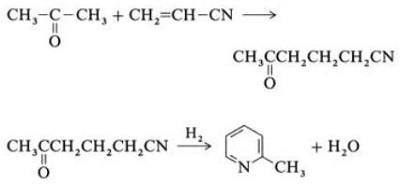 Figura 2-5Síntesis de 2-metilpiridina a partir de acrilonitrilo y acetona La síntesis a partir de acrilonitrilo y acetona produce 2-metilpiridina de forma selectiva, que puede desalquilarse a piridina. Primero, la reacción de acrilonitrilo y acetona, catalizada por una amina alifática primaria como la isopropilamina y un ácido débil como el ácido benzoico, ocurre en fase líquida a 180 °C y 2,2 MPa para dar 5-oxohexanonitrilo, con 91 % selectividad. La conversión de acrilonitrilo es 86%. Luego se llevan a cabo la ciclación y deshidratación del producto inicial en fase gaseosa en presencia de hidrógeno sobre un catalizador que contiene paladio, níquel o cobalto a 240ºC para dar 2-metilpiridina con un rendimiento del 84%. 2.6 Síntesis a partir de dinitrilos En una reacción en fase de vapor sobre un catalizador que contiene níquel en presencia de hidrógeno, 2-metilglutaronitrilo da 3-metilpiperidina, que luego se deshidrogena sobre paladio-alúmina para dar 3-metilpiridina. Y la 3-metilpiridina también se puede desalquilar a piridina. 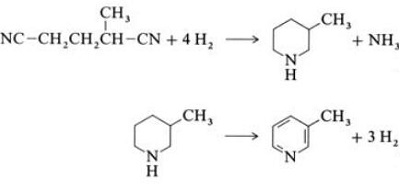 Figura 2-6Síntesis de 2-metilpiridina a partir de dinitrilos Se informa que una reacción en fase gaseosa de un solo paso sobre un catalizador que contiene paladio produce 3-metilpiridina con un rendimiento del 50%. 2.7 Biosíntesis Varios derivados de piridina desempeñan funciones importantes en los sistemas biológicos. Si bien su biosíntesis no se comprende completamente, el ácido nicotínico (vitamina B3) se encuentra en algunas bacterias, hongos y mamíferos. Los mamíferos sintetizan ácido nicotínico mediante la oxidación del aminoácido triptófano, donde un producto intermedio, la anilina, crea un derivado de piridina, la quinurenina. Por el contrario, las bacterias Mycobacterium tuberculosis y Escherichia coli producen ácido nicotínico por condensación de gliceraldehído 3-fosfato y ácido aspártico. 2.8 Otros métodos El etileno y el amoníaco reaccionan en presencia de un catalizador complejo de paladio para dar 2-metilpiridina y MEP. La piridina se puede preparar a partir de ciclopentadieno mediante amoxidación o a partir de 2-pentenonitrilo mediante ciclación y deshidrogenación. El alcohol furfurílico o furfural reacciona con el amoníaco en fase gaseosa para dar piridina. 2-La metilpiridina también se prepara a partir de anilina. |
| Usos | 3.1 Disolvente La piridina (110-86-1) es un disolvente polar, básico y poco reactivo, especialmente para reacciones de deshidrocloración y extracción de antibióticos. En la reacción de eliminación, la piridina actúa como base de la reacción de eliminación y une el haluro de hidrógeno resultante para formar una sal de piridinio. En esterificaciones y acilaciones, la piridina activa los haluros o anhídridos de ácido carboxílico. 3.2 Medicamentos La estructura química de la piridina se puede encontrar en varios medicamentos que se sintetizan gracias en parte a la piridina. Un ejemplo es un medicamento llamado esomeprazol, el nombre genérico de Nexium. Este es un medicamento que se usa para tratar la ERGE o enfermedad por reflujo gastroesofágico. Otro ejemplo de un medicamento que contiene piridina es la loratadina, más comúnmente conocida por su marca Claritin. Loratadina ayuda en el tratamiento de las alergias. 3.3 Pesticidas El uso principal de la piridina es como precursor de los herbicidas paraquat y diquat. El primer paso de síntesis del insecticida clorpirifos consiste en la cloración de la piridina. La piridina también es el compuesto de partida para la preparación de fungicidas a base de piritiona. El cetilpiridinio y el laurilpiridinio, que pueden producirse a partir de piridina mediante una reacción de Zincke, se utilizan como antisépticos en productos para el cuidado bucal y dental. La piridina es fácilmente atacada por agentes alquilantes para dar sales de N-alquilpiridinio. Un ejemplo es el cloruro de cetilpiridinio.  Fig 3-1 Síntesis de paraquat 3.4 Síntesis de piperidina La piperidina, un heterociclo de nitrógeno fundamental, es un importante componente sintético. Las piperidinas se producen mediante hidrogenación de piridina con un catalizador a base de níquel, cobalto o rutenio a temperaturas elevadas. C5H5N + 3 H2 → C5H10NH3.5 Ligando y base de Lewis La piridina se utiliza ampliamente como ligando en la química de coordinación. Como ligando de un complejo metálico, puede reemplazarse fácilmente por una base de Lewis más fuerte, que puede usarse en la catálisis de reacciones de polimerización e hidrogenación. Una vez completada la reacción, el ligando de piridina reemplazado durante la reacción se puede restaurar nuevamente. La piridina también se utiliza como base en reacciones de condensación. Como base, la piridina se puede utilizar como reactivo de Karl Fischer, pero generalmente se reemplaza por alternativas con un olor más agradable, como el imidazol. 3.6 Otros Excepto por los usos anteriores, la piridina también se usa para producir resinas de policarbonato, vitaminas, saborizantes alimentarios, pinturas, tintes, productos de caucho, adhesivos e impermeabilizantes para telas. Se añade piridina al etanol para hacerlo inadecuado para beber. También se utiliza en la síntesis in vitro de ADN. |
| Información de toxicidad | 4.1 Nivel de toxicidad Baja toxicidad 4.2 Toxicidad aguda LD501580 mg/kg (ratones grandes, oral); 1121 mg/kg (Conejo, a través de la piel); inhalado por humanos 25 mg/m3×20 min, irritación de la conjuntiva y la mucosa del tracto respiratorio superior. Toxicidad subaguda y crónica: inhalado por ratones grandes 32,3 mg/m3×7 horas/día x5 días/semana x6 meses, aumento del peso del hígado; inhalado por humanos 20-40mg/m3 (a largo plazo), daño a los nervios, marcha inestable, temblores digitales, presión arterial baja, sudoración excesiva, daño hepático y renal ocasional. |
| Peligros | 5.1 Peligros para la salud La piridina es extremadamente tóxica por ingestión e inhalación. Los vapores son más pesados que el aire. su combustión produce óxidos de nitrógeno tóxicos. La piridina es muy inflamable (su punto de inflamación es de apenas 17 ºC). La piridina también podría tener efectos neurotóxicos y genotóxicos. 5.2 Riesgos de incendio Comportamiento en caso de incendio: El vapor es más pesado que el aire y puede viajar una distancia considerable hasta la fuente de ignición y regresar. |
| Referencias |
https://en.wikipedia.org/wiki/Piridina#Ocurrencia http://www.zwbk.org/MyLemmaShow.aspx?zh=zh-tw&lid=169038 http://www.softschools.com/formulas/chemistry/piridina_formula/378/ http://www.hmdb.ca/metabolites/HMDB0000926 https://study.com/academy/lesson/pyridine-in-medicine-uses-synchronous.html#partialRegFormModal http://www.toxipedia.org/display/toxipedia/Piridina https://www.chemicalbook.com/ProductChemicalPropertiesCB8852825_ES.htm https://pubchem.ncbi.nlm.nih.gov/compound/pyridine#section=Arriba http://www.ebi.ac.uk/chebi/searchId.do;jsessionid=E7088896622D62FC650863C2AD197CAA?chebiId=CHEBI:16227 https://www.britannica.com/science/piridina Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. (2005), "Pyridine and Pyridine Derivatives", Enciclopedia de química industrial de Ullmann, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_399 |
| Propiedades químicas | La piridina, es un líquido ligeramente amarillo o incoloro; higroscópico; olor no placentero; sabor ardiente; reacción ligeramente alcalina; soluble en agua, alcohol, éter, benceno y aceites grasos; gravedad específica, 0.978; Temperatura de autoignición, 482 grados. La piridina, una amina terciaria, es una base algo más fuerte que la anilina y forma fácilmente sales de amonio cuaternario. |
| Propiedades químicas | La piridina es una base débil (pKa{{0}}.25); una solución 0,2 M tiene un pH de 8,5 (HSDB 1988). Sus átomos de carbono están desactivados hacia la sustitución electrófila. Esto es especialmente cierto en medios ácidos, donde se forman sales en el nitrógeno. Sin embargo, sufre fácilmente sustitución nucleofílica, preferentemente en la posición C-2 y también en la posición C-4 (Jori et al 1983). Al ser una amina terciaria, la piridina reacciona con agentes alquilantes para formar sales cuaternarias (Santodonato et al 1985). Debido a su reducida capacidad para donar electrones, es más resistente a la oxidación que el benceno. La oxidación con peroxiácidos forma N-óxido de piridina que luego es capaz de sufrir sustitución electrófila (Jori et al 1983). La piridina reacciona violentamente con varios compuestos, incluidos el ácido nítrico, el ácido sulfúrico, el anhídrido maleico, el percromato, la betapropiolactona y el ácido clorosulfónico. La descomposición térmica puede liberar cianuros (Gehring 1983). Tanto el ion piridinio como la piridina misma se reducen fácilmente al compuesto comercialmente importante, piperidina (Jori et al 1983). |
| Propiedades físicas | Líquido inflamable, transparente, de incoloro a amarillo pálido, con un olor agudo, penetrante y nauseabundo, parecido al del pescado. Las concentraciones umbral de olor en agua y aire fueron 2 ppm (Buttery et al., 1988) y 21 ppbv(Leonardos et al., 1969), respectivamente. Umbral de detección de concentraciones de olor de 0.74 mg/m3(2,3 ppmv) y 6 mg/m3(1,9 ppmv) fueron determinados experimentalmente por Katz y Talbert (1930) y Dravnieks (1974), respectivamente. Cometto-Muñiz y Cain (1990) informaron una concentración umbral de pungencia nasal promedio de 1275 ppm.v. |
| Ocurrencia | La piridina fue descubierta por Anderson en el alquitrán de hulla en 1846 (Windholz et al 1983). Se encuentra en el humo del tabaco (Vohl y Eulenberg 1871; Lehmann 1909) y en el café tostado (Bertrand y Weisweiller 1913). La piridina se encuentra en el aceite de madera y en las hojas y raíces de Atropa belladonna (HSDB 1988), y también es un componente del aceite de creosota (Krone et al 1986). En la naturaleza, la piridina y sus derivados se encuentran comúnmente como componentes de alcaloides, vitaminas y coenzimas. |
| Usos | La piridina se utiliza como disolvente en las industrias de pinturas y caucho; como intermediario en colorantes y productos farmacéuticos; para desnaturalizar alcohol; y como reactivo para análisis de cianuro. Ocurre en el alquitrán de hulla. |
| Usos | La piridina se utiliza directamente en la desnaturalización del alcohol (ACGIH 1986; HSDB 1989; NSC 1978) y como disolvente en la preparación de pinturas y caucho (ACGIH 1986; HSDB 1989; NSC 1978) y en laboratorios de investigación para funciones como la extracción de hormonas vegetales ( Santodonato et al. 1985). La mitad de la piridina producida hoy en día se utiliza como intermediario en la fabricación de diversos insecticidas y herbicidas para aplicaciones agrícolas (ACGIH 1986; Harper et al. 1985; Santodonato et al. 1985). Aproximadamente el 20% se destina a la producción de piperidina (Harper et al. 1985; Santodonato et al. 1985), que tiene importancia comercial en la preparación de productos químicos utilizados en la vulcanización del caucho y la agricultura (NSC 1978). La piridina también se utiliza como intermediario en la preparación de fármacos (antihistamínicos, esteroides, agentes antibacterianos tipo sulfa y otros), colorantes, repelentes de agua y resinas de policarbonato (ACGIH 1986; Harper et al. 1985; NSC 1978; Santodonato et al. 1985). La piridina también está aprobada por la Administración de Alimentos y Medicamentos (FDA) para su uso como agente aromatizante en la preparación de alimentos (Harper et al. 1985; HSDB 1989). |
| Definición | ChEBI: la piridina es un azaareno que comprende un núcleo de benceno en el que un grupo -CH se reemplaza por un átomo de nitrógeno. Es el compuesto original de la clase piridinas. Las moléculas tienen un anillo plano hexagonal y son isoelectrónicas con el benceno. La piridina es un ejemplo de compuesto heterocíclico aromático, con los electrones en los enlaces pi carbono-carbono y el par solitario del nitrógeno deslocalizado sobre el anillo de átomos. El compuesto se extrae del alquitrán de hulla y se utiliza como disolvente y como materia prima para la síntesis orgánica. |
| Métodos de producción | La piridina se produce a partir de los gases obtenidos por coquización del carbón y por síntesis directa. La fracción de aceite ligero del alquitrán de hulla se trata con ácido sulfúrico para producir sales de piridina solubles en agua y luego las bases de piridina se recuperan de la fase acuosa mediante hidróxido de sodio o amoníaco (Jori et al 1983). La mayor parte de la producción estadounidense se realiza por medios sintéticos. Este proceso utiliza una reacción en fase de vapor de acetaldehído, formaldehído y amoníaco, que produce una mezcla de piridina y 3-metilpiridina (Santodonato et al 1985). La proporción del producto depende de las cantidades relativas de acetaldehído y formaldehído. El metanol añadido aumenta el rendimiento. La producción estadounidense de piridina se estimó entre 32 y 47 millones de libras en 1975 (Reinhardt y Brittelli 1981). La piridina está disponible comercialmente en grados técnicos, de 2 grados y de 1 grado; los dos últimos se refieren a sus rangos de ebullición. Las principales impurezas son homólogos de punto de ebullición más alto, como picolinas, lutidinas y colidinas, que son mono, di y trimetilpiridinas (Santodonato et al 1985; Jori et al 1983). |
| Preparación | La piridina se produce mediante aislamiento de fuentes naturales como el carbón o mediante síntesis química (HSDB 1989). La piridina se produce mediante la destilación fraccionada de residuos de alquitrán de hulla (HSDB 1989; NSC 1978; Santodonato et al. 1985) en la que 1 tonelada de carbón produce 0.07-0.21 libras de bases de piridina de del cual el 57% es piridina (Santodonato et al, 1985). La piridina producida sintéticamente es actualmente la fuente más importante de piridina para usos comerciales (Santodonato et al. 1985). Se sintetizan pequeñas cantidades de piridina a partir de acetaldehído, formaldehído y amoníaco con un catalizador de sílice-alúmina fluidizada, seguido de fraccionamiento para aislar la piridina (Harper et al. 1985; HSDB 1989; NSC 1978). La piridina es producida a partir de fuentes naturales por Crowley Tar Products de Stow, Ohio, y Oklahoma City, Oklahoma (Harper et al. 1985; HSDB 1989; SRI 1986, 1987, 1988). La piridina es producida sintéticamente por dos empresas, Nepera Chemical Co. de Harriman, Nueva York y Reilly Tar and Chemical Corporation de Indianápolis, Indiana (Harper et al. 1985; SRI 1986, 1987, 1988). |
| Valores umbrales de aroma | Detección: 0.079 a 790 ppb; reconocimiento: 7,9 a 40 ppm |
| Descripción general | Líquido transparente, de incoloro a amarillo claro, con un olor penetrante y nauseabundo. Densidad 0.978 g/cm3. Punto de inflamación 68 grados F. Los vapores son más pesados que el aire. Tóxico por ingestión e inhalación. La combustión produce óxidos de nitrógeno tóxicos. |
| Reacciones del aire y el agua | Altamente inflamable. Soluble en agua. |
| Perfil de reactividad | El azabenceno es una base. Reacciona exotérmicamente con ácidos. Durante la preparación de un complejo de azabenceno con trióxido de cromo, un ácido, se incrementó la proporción de trióxido de cromo. El calentamiento de esta reacción ácido-base provocó una explosión y un incendio [Historia del caso de MCA 1284 1967]. Una solución de 0.1% de azabenceno (u otra amina terciaria) en anhídrido maleico a 185 grados produce una descomposición exotérmica con rápido desprendimiento de gas [Chem Eng. Noticias 42(8); 41 1964]. La mezcla de azabenceno en porciones molares iguales con cualquiera de las siguientes sustancias en un recipiente cerrado provocó que la temperatura y la presión aumentaran: ácido clorosulfónico, ácido nítrico (70%), óleum, ácido sulfúrico (96%) o propiolactona [NFPA 1991]. La combinación de yodo, azabenceno, trióxido de azufre y formamida desarrolló una sobrepresurización de gas después de varios meses. Esto surgió de la lenta formación de ácido sulfúrico a partir del agua externa o de la deshidratación de la formamida en cianuro de hidrógeno. El óxido de etileno y el SO2 pueden reaccionar violentamente en una solución de azabenceno con presurización si el óxido de etileno está en exceso (Nolan, 1983, Case History 51). |
| Peligro | Inflamable, peligroso riesgo de incendio, límites de explosividad en el aire 1,8–12,4%. Tóxico por ingestión e inhalación. Irritante de la piel, daño hepático y renal. Carcinógeno cuestionable. |
| Peligro para la salud | La toxicidad aguda de la piridina es baja. La inhalación causa irritación del sistema respiratorio y puede afectar el sistema nervioso central, provocando dolor de cabeza, náuseas, vómitos, mareos y nerviosismo. La piridina irrita los ojos y la piel y se absorbe fácilmente, lo que provoca efectos sistémicos. La ingestión de piridina puede provocar daños hepáticos y renales. La piridina provoca fatiga olfativa y su olor no advierte adecuadamente de la presencia de concentraciones nocivas. No se ha encontrado que la piridina sea cancerígena ni muestre toxicidad para la reproducción o el desarrollo en humanos. La exposición crónica a la piridina puede provocar daños al hígado, los riñones y el sistema nervioso central. |
| Peligro para la salud | Los efectos tóxicos de la piridina incluyen dolor de cabeza, mareos, nerviosismo, náuseas, insomnio, micción frecuente y dolor abdominal. Los síntomas fueron transitorios y ocurrieron en personas por exposición subaguda a vapores de piridina a aproximadamente 125 ppm durante 4 horas al día durante 1 a 2 semanas (Reinhardt y Brittelli 1981). Los órganos diana de la toxicidad de la piridina son el sistema nervioso central, el hígado, los riñones, el tracto gastrointestinal y la piel. Las vías de exposición son la inhalación de vapores y la ingestión y absorción del líquido a través de la piel. Pueden surgir graves riesgos para la salud por la inhalación crónica, que puede causar daño renal y hepático, y por la estimulación de la médula ósea para aumentar la producción de plaquetas sanguíneas. La exposición a niveles bajos de 10 ppm puede producir efectos de envenenamiento crónico en el sistema nervioso central. La ingestión del líquido puede producir los mismos síntomas que los indicados anteriormente. El contacto con la piel puede causar dermatitis. El vapor es irritante para los ojos, la nariz y los pulmones. Debido a su fuerte olor desagradable, siempre hay una advertencia suficiente contra una sobreexposición. Una concentración de 10 ppm es indeseable para los seres humanos. Valor LCLO, inhalación (ratas): 4000 ppm/4 h Valor LD50, oral (ratones): 1500 mg/kg. Huh y colaboradores (1986) investigaron el efecto del ácido glicirretínico sobre la toxicidad de la piridina en ratones. El pretratamiento con ácido glicirretínico disminuyó la depresión del sistema nervioso central y la mortalidad en animales inducida por piridina. Dicho pretratamiento disminuyó notablemente la actividad de la enzima transaminasa sérica y aumentó la actividad de la anilina hidroxilasa microsomal hepática [9012-90-0], una enzima que metaboliza la piridina. |
| Inflamabilidad y explosibilidad | La piridina es un líquido altamente inflamable (clasificación NFPA=3) y su vapor puede viajar una distancia considerable y "retroceder". El vapor de piridina forma mezclas explosivas con el aire en concentraciones del 1,8 al 12,4% (en volumen). Se deben utilizar extintores de dióxido de carbono o de productos químicos secos para los incendios de piridina. |
| Usos industriales | La piridina es un buen disolvente para una gran cantidad de compuestos, tanto orgánicos como inorgánicos (Windholz et al 1983). Alrededor del 50% de la piridina utilizada en Estados Unidos se destina a la producción de productos químicos agrícolas, como los herbicidas paraquat, diquat y triclopir y el insecticida clorpirifos. Otros usos son la producción de piperidina; la fabricación de productos farmacéuticos, como esteroides, vitaminas y antihistamínicos; y como disolvente. Los usos de disolventes se encuentran tanto en la industria farmacéutica como en la de resinas de policarbonato. Es particularmente útil como solvente en procesos donde se desprende HC1 (Santodonato et al 1985). Los usos menores de la piridina son la desnaturalización de mezclas de alcohol y anticongelantes, como auxiliar de teñido en textiles y como agente aromatizante (Jori et al 1983; Furia 1968; HSDB 1988). |
| Contacto alérgenos | La piridina (piridina no sustituida) y su derivado (piridinas sustituidas) se utilizan ampliamente en química. La piridina es un disolvente utilizado para muchos compuestos orgánicos y sales químicas metálicas anhidras. Contenido en el reactivo de Karl Fischer, indujo dermatitis de contacto en un técnico de laboratorio. No se observa sensibilidad cruzada entre esas diferentes sustancias. |
| Perfil de seguridad | Veneno por vía intraperitoneal. Moderadamente tóxico por ingestión, contacto con la piel, vía intravenosa y subcutánea. Ligeramente tóxico por inhalación. Un irritante severo para la piel y los ojos. Se informaron datos de mutación. Puede causar depresión del sistema nervioso central, malestar gastrointestinal y daño hepático y renal. Un líquido inflamable y peligroso riesgo de incendio cuando se expone al calor, llamas u oxidantes. Peligro de explosión grave en forma de vapor cuando se expone a llamas o chispas. Reacciona violentamente con ácido clorosulfónico, trióxido de cromo, tetraóxido de dinitrógeno, HNO3, óleum, percromatos, propiolactona, AgClO4, H2SO4. Reacción incandescente con flúor. Reacciona para formar productos pirofóricos o explosivos con trifluoruro de bromo, hipofluorito de trifluorometilo. Las mezclas con formamida + yodo + trióxido de azufre son peligrosas durante el almacenamiento, ya que liberan dióxido de carbono y ácido sulfúrico. Incompatible con materiales oxidantes. Reacciona con anhídrido maleico (por encima de 150 grados) generando dióxido de carbono. Para combatir el fuego utilice espuma de alcohol. Cuando se calienta hasta su descomposición, emite vapores de NOx altamente tóxicos. |
| Posible exposición | La piridina se utiliza como disolvente en la industria química y como desnaturalizante del alcohol etílico; como intermediario en la producción de pesticidas; en productos farmacéuticos; en la fabricación de pinturas, explosivos, colorantes, caucho, vitaminas, sulfonamidas; y desinfectantes. |
| Carcinogenicidad | La piridina no fue cancerígena en varios estudios subcutáneos crónicos. A las ratas F344 se les administró piridina por vía oral en agua potable en dosis de 0, 7, 14 o 33 mg/kg durante 2 años. La dosis máxima produjo una disminución del peso corporal y del consumo de agua. Se observó un aumento de adenoma o carcinoma tubular renal e hiperplasia tubular en machos con 33 mg/kg. Se observó un aumento de la leucemia de células mononucleares en las hembras con dosis de 14 y 33 mg/kg, lo que se consideró equívoco en términos de la relación con la exposición a la piridina, ya que es un hallazgo común en esta cepa de rata. Se observaron cambios no neoplásicos en el hígado relacionados con la concentración a 33 mg/kg. Se trataron de manera similar ratas Wistar macho con dosis de 0, 8, 17 o 36 mg/kg durante 2 años. Se observó una disminución de la supervivencia y del peso corporal con 17 y 36 mg/kg. Se observó un aumento de adenomas de células testiculares con 36 mg/kg. No se informaron cambios en las tasas de supervivencia o neoplasias en otros tejidos, incluido el riñón, aunque se observó un aumento de la nefropatía y la degeneración/necrosis centrolobulillar hepática en algunas ratas tratadas con piridina. |
| Fuente | La piridina se encuentra naturalmente en las patatas, la anábasis, las hojas de beleño, la menta (0 a 1 ppb), las hojas de té y las hojas de tabaco (Duke, 1992). Identificado como uno de los 140 componentes volátiles en los aceites de soja usados recolectados de una planta procesadora que frió diversos productos de carne de res, pollo y ternera (Takeoka et al., 1996). |
| Destino ambiental | Biológico.Heukelekian y Rand (1955) informaron un valor de DBO 5-d de 1,31 g/g, que es el 58,7% del valor de DBO de 2,23 g/g. Una Nocardia sp. aislado del suelo fue capaz de transformar la piridina, en presencia de semicarbazida, en un producto intermedio identificado como semialdehído del ácido succínico (Shukla y Kaul, 1986). 1,4-La dihidropiridina, el dialdehído glutárico, el semialdehído del ácido glutárico y el ácido glutárico se identificaron como productos intermedios cuando la piridina fue degradada por la cepa Z1 de Nocardia (Watson y Cain, 1975). Fotolítico.La irradiación de una solución acuosa a 50 grados durante 24 h dio como resultado un rendimiento de dióxido de carbono del 23,06% (Knoevenagel y Himmelreich, 1976). Químico/Físico.La reacción en fase gaseosa del ozono con piridina en aire sintético a 23 grados produjo una sal nitrada que tiene la fórmula: [C6H5NH]+NO3 - (Atkinson et al., 1987). Se estudió la ozonización de piridina en soluciones acuosas a 25 grados con y sin la adición de alcohol terc-butílico (20 mM) como eliminador de radicales. Con alcohol terc-butílico, la ozonización de piridina produjo principalmente N-óxido de piridina (rendimiento del 80%), que era muy estable frente al ozono. Sin alcohol terc-butílico, el anillo heterocíclico se escinde rápidamente formando amoníaco, nitrato y el compuesto amídico ácido N-formiloxámico (Andreozzi et al., 1991). |
| Metabolismo | La piridina se absorbe a través del tracto gastrointestinal, la piel y los pulmones y se elimina a través de la orina, las heces, la piel y los pulmones, tanto como metabolitos como como compuesto original (Jori et al 1983). La absorción por los tejidos aumenta con la dosis y la eliminación es de naturaleza bifásica (Zharikov y Titov 1982; HSDB 1988). La eliminación es rápida y no parece haber acumulación de tejido (Jori et al 1983). La observación de His (1887) de la excreción urinaria de Af-metilpiridina por animales a los que se les administró piridina fue el primer ejemplo de Af-metilación. Los metabolitos urinarios conocidos de la piridina en los mamíferos ahora incluyen N-óxido de piridina, N-metilpiridina, 4-piridona, 2-piridona e 3-hidroxipiridina. Algunos metabolitos aún quedan por identificar (Damani et al 1982). Las cantidades relativas de los metabolitos dependen en gran medida de la especie y la dosis (Gorrod y Damani 1980). Por ejemplo, se ha demostrado que la rata excreta el 70% de una dosis de 1 mg/kg en la orina en las primeras 24 h después de la dosis, pero esa cifra cae a sólo el 5,8% para una dosis de 500 mg/kg (D'Souza et al. al 1980). Aunque la excreción urinaria de piridina y sus metabolitos parece ser una ruta principal de eliminación, la excreción no urinaria no se ha estudiado ampliamente (Santodonato et al 1985). En conejos, se ha demostrado que la actividad de la piridina N-metiltransferasa es mayor en el citosol pulmonar y se ha descubierto que utiliza 5-adenosil metionina como donante de metilo (Damani et al 1986). Esta vía es saturable tanto en la rata como en el cobayo (D'Souza et al 1980). El producto de esta reacción, la N-metilpiridina, es menos tóxico crónicamente pero más agudamente tóxico que la piridina (Williams 1959). El N-óxido de piridina es producido por el sistema del citocromo P-450 y la actividad es inducida por el pretratamiento con fenobarbital o piridina, pero no por el 3-metilcolantreno (Gorrod y Damani 1979; Kaul y Novak 1987). En el conejo, la P-450 LM inducible por alcohol (y inducible por piridina)3Aparece ser la K bajamisoenzima que cataliza la producción de óxido Af de piridina (Kim y Novak 1989). La N-oxidación de la piridina puede representar una vía de bioactivación (Santodonato et al 1985) y esta vía se vuelve más importante a medida que aumenta la dosis de piridina (Damani et al 1982). |
| almacenamiento | La piridina debe usarse sólo en áreas libres de fuentes de ignición y cantidades superiores a 1 litro deben almacenarse en recipientes metálicos herméticamente cerrados en áreas separadas de oxidantes. |
| Envío | UN1992 Líquidos inflamables, tóxicos, nos, Clase de peligro: 3; Etiquetas: 3-Líquido inflamable, 6.1-Materiales venenosos, Nombre técnico requerido. |
| Métodos de purificación | Las impurezas probables son H2O y aminas como las picolinas y las lutidinas. La piridina es higroscópica y miscible con H2O y disolventes orgánicos. Se puede secar con KOH, NaOH, CaO, BaO o sodio sólidos, seguido de destilación fraccionada. Otros métodos de secado incluyen el reposo con tamices moleculares Linde tipo 4A, CaH2 o LiAlH4, la destilación azeotrópica del H2O con tolueno o *benceno, o el tratamiento con bromuro de fenilmagnesio en éter, seguido de la evaporación del éter y la destilación de la piridina. Un método recomendado [Lindauer Mukherjee Pure Appl Chem 27 267 1971] seca la piridina sobre KOH sólido (20 g/kg) durante 2 semanas y destila fraccionadamente el sobrenadante sobre tamices moleculares Linde tipo 5A y KOH sólido. El producto se almacena bajo nitrógeno libre de CO2-. La piridina se puede almacenar en contacto con BaO, CaH2 o tamices moleculares. Los materiales no básicos se pueden eliminar destilando al vapor una solución que contenga 1,2 equivalentes de H2SO4 al 20 % o HCl al 17 % hasta que aproximadamente el 10 % de la base se haya arrastrado junto con las impurezas no básicas. A continuación se alcaliniza el residuo, se separa la base, se seca con NaOH y se destila fraccionadamente. Alternativamente, la piridina se puede tratar con agentes oxidantes. Así, se agitó piridina (800 ml) durante 24 horas con una mezcla de sulfato cérico (20 g) y K2CO3 anhidro (15 g), luego se filtró y se destiló fraccionadamente. Hurd y Simon [J Am Chem Soc 84 4519 1962] agitaron piridina (135 ml), agua (2,5 l) y KMnO4 (90 g) durante 2 horas a 100 °C y luego reposaron durante 15 horas antes de filtrar los óxidos de manganeso precipitados. La adición de KOH sólido (aproximadamente 500 g) provocó la separación de la piridina. Se decantó, se puso a reflujo con CaO durante 3 horas y se destiló. La separación de la piridina de algunos de sus homólogos se puede lograr mediante la cristalización de los oxalatos. La piridina se precipita como su oxalato agregándola a la solución agitada de ácido oxálico en acetona. El precipitado se filtra, se lava con acetona fría y se regenera y aísla la piridina. Otros métodos se basan en la formación de complejos con ZnCl2 o HgCl2. |
| Incompatibilidades | Reacción violenta con oxidantes fuertes; ácidos fuertes; ácido clorosulfónico; anhídrido maleico; yodo oleum. |
| Deposito de basura | Incineración controlada mediante la cual los óxidos de nitrógeno se eliminan del gas efluente mediante dispositivos depuradores, catalíticos o térmicos. |
| Productos de preparación de piridina y materias primas. |
| Materias primas | Sulfuric acid-->Ammonia-->Benzene-->COAL TAR-->3-Picoline-->COKEOVENGAS-->1,5-DICLORURO DE DIAMINOPENTANO |
| Productos de preparación | Methyl 2-Fluoroisonicotinate-->2-ACETYL-5-CYANOTHIOPHENE-->5-BROMO-2-FLUOROCINNAMIC ACID-->4-NITROISOPHTHALIC ACID-->3,5-DIMETHOXYCINNAMIC ACID-->2-(2-Butoxyethoxy)ethyl acetate-->2,4-MESITYLENEDISULFONYL DICHLORIDE-->(4-FLUORO-BENZYL)-METHYL-AMINE-->1-Phenacylpyridinium bromide-->3-(TRIFLUOROMETHOXY)CINNAMIC ACID-->trans-Ferulic acid-->3-(Trifluoromethyl)pyrazole-->4-Fluorocinnamic acid-->Indigosol Green Blue IBC-->2-Amino-4-methyl-5-acetylthiazole-->Benzyl 2-chloroacetate-->5-ACETAMIDONICOTINIC ACID-->7-ACETOXYCOUMARIN-->2-AMINO-4-METHYL-QUINOLINE-3-CARBONITRILE-->N-PHENYLISONICOTINAMIDE-->Allyl methyl carbonate-->Pyridine-3-sulfonyl chloride hydrochloride-->Syringaldehyde-->2,4,5,6-TETRAMETHYLBENZENEDISULFONYL DICHLORIDE-->3-(3-METHYL-2-THIENYL)ACRYLIC ACID-->Vat Grey M-->17beta-Hydroxy-17-methylandrosta-4,9(11)-dien-3-one-->butyl N-phenylcarbamate-->3-Methoxycinnamic acid-->1-CHLORO-2-METHYLPROPYL CHLOROFORMATE-->Pyrazinecarbonitrile-->2-AMINO-6-CHLORO-3,5-DICYANOPYRIDINE-->4-BROMO-TETRAHYDROPYRAN-->Phenylcarbamic acid propyl ester-->Hydrocortisone acetate-->5-METHYLPICOLINIC ACID-->4-Acetamido-2-chloropyridine-->Pyridinium p-Toluenesulfonate-->1,2,4-Triazolo[4,3-a]pyridin-3(2H)-one-->dicloruro de paraquat |
Etiqueta: piridina, fabricantes, proveedores, fábrica de piridina de China
También podría gustarte
-

Precio competitivo CAS 624-89-5 Sulfuro de metil etil
-

Venta de fábrica CAS 100-06-1 4-metoxiacetofenona
-

Precio de fábrica Mejor precio CAS 577-16-2 2-Metilacetofenona
-

Aditivos alimentarios de calidad alimentaria CAS 93-92-5 Acetato de estiralilo
-

CAS 1335-66-6 de la fábrica china isociclocitral
-

2-Etoxinaftaleno
Envíeconsulta

